Les anticorps sont des protéines de la famille des immunoglobulines. Les anticorps reconnaissant des molécules spécifiquement exprimées par les cellules cancéreuses (antigènes tumoraux) ont la capacité de cibler les tumeurs afin de les visualiser (diagnostic) ou d’aider à les détruire (thérapie).
Les anticorps monoclonaux utilisés en clinique proviennent encore souvent de la souris et ont été produits suivant la technique d’hybridation somatique mise au point par Georges Köhler et Cesar Milstein en 1975.
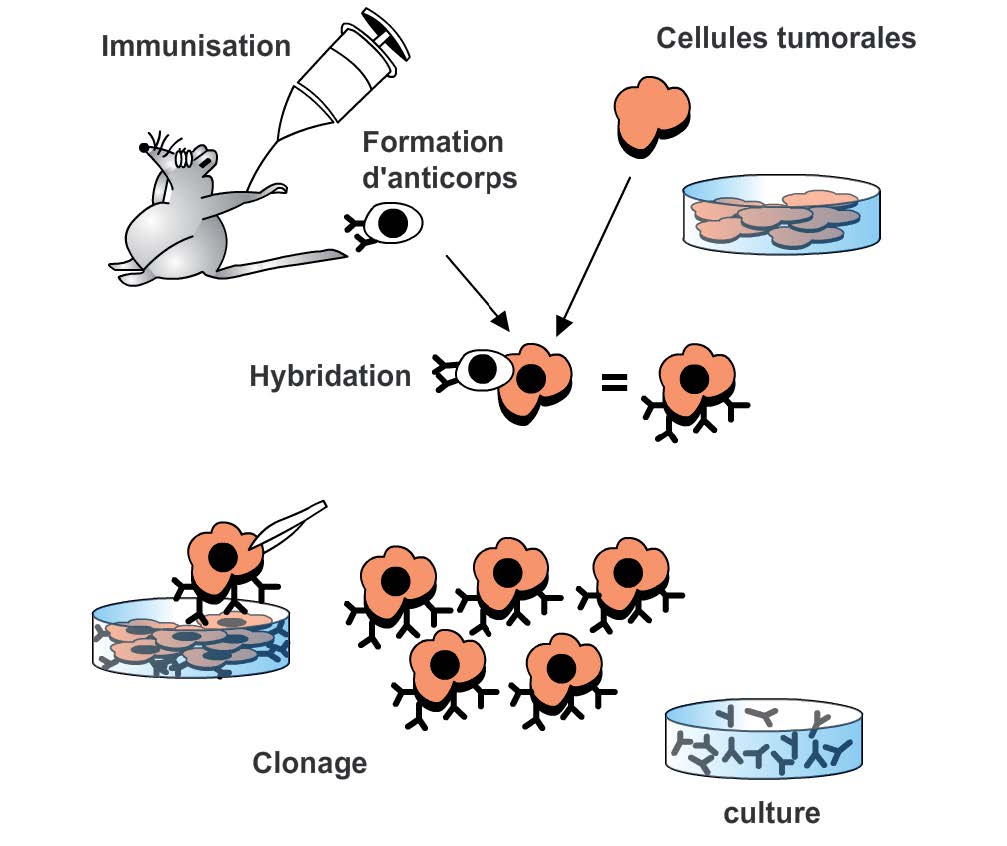
La première étape est l’inoculation d’un antigène à un animal de laboratoire (souvent un rongeur, les plus courants étant la souris et le rat), ce qui a pour effet de libérer des anticorps. Ensuite, l’animal est sacrifié et les lymphocytes sont isolés à partir d’un organe, la rate. Ceux-ci ne peuvent pas se multiplier mais produisent les anticorps désirés. L’hybridation somatique consiste à fusionner ces lymphocytes avec des cellules de myélome (cellules cancéreuses, donc aptes à une division cellulaire rapide et indéfinie). Ces cellules, appelées hybridomes, sont ensuite mises en culture.
Ces hybridomes secrètent des anticorps tous différents. Afin de sélectionner l’anticorps d’intérêt, il faut d’abord isoler chacun des clones. Classiquement, cette sélection se fait par dilution limite pour permettre l’isolement de clones, c’est-à-dire de lignées cellulaires provenant d’une cellule unique. Après la sélection, la production de lots d’anticorps se fait par purification du milieu biologique dans lequel les hybridomes se sont multipliés et qui contient donc l’anticorps souhaité.
Ces anticorps de souris peuvent entraîner une réponse immune du patient contre cette protéine étrangère. Cette réponse, connue sous le nom de Hama (human anti-mouse antibodies), limite le nombre d’injections que l’on peut réaliser chez un même patient. Des solutions ont été cherchées et les techniques d’amélioration, de génération et de fabrication des anticorps utilisables chez l’homme ont beaucoup progressé :
- chimérisation et humanisation des anticorps de souris pour diminuer ou éviter les réponses immunes
- isolement d’anticorps monoclonaux humains à partir de souris transgéniques « humanisées »
- isolement d’anticorps monoclonaux humains (mono-catenaires) à partir de banques de phages contenant des gènes
- humains d’immunoglobulines de complexité élevée
- introduction de techniques de maturation d’affinité efficaces
Ces anticorps améliorés sont produits en cultivant les cellules qui les sécrètent en très grandes quantités. Ils sont isolés et purifiés par chromatographie. Ces opérations sont effectuées dans des conditions qui garantissent leur qualité et l’absence de contamination bactérienne ou virale. Les anticorps thérapeutiques commerciaux sont produits à l’échelle industrielle par lots de plusieurs dizaines de kilogrammes.
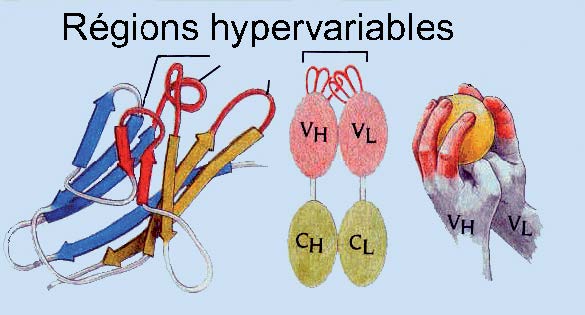
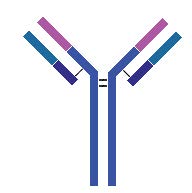
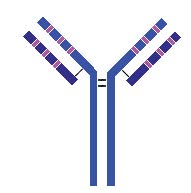
Ces améliorations sont rendues possibles par la structure moléculaire des immunoglobulines. Les immunoglobulines de type G, qui sont utilisées la plupart du temps dans les applications médicales, possèdent deux chaînes polypeptidiques appelées H (lourde ou longue) et L (légère ou courte) associées par des ponts di-sulfures. Chaque couple chaîne H – chaîne L forme un site de liaison pour l’antigène. La capacité des anticorps à fixer l’antigène est portée par six boucles peptidiques : trois sur la chaîne H, trois sur la chaîne L, qu’on appelle les régions hypervariables. On peut se représenter cette interaction comme trois doigts de chaque main droite et gauche tenant une orange (l’antigène) (A). Le reste de la molécule d’anticorps est beaucoup plus constant, quasiment identique d’un anticorps à un autre et très homologue entre l’homme et la souris. On peut alors échanger toute la partie de chaque chaîne H et L portant ces boucles, les domaines VH et VL, pour conférer à un anticorps humain la capacité à reconnaître le même antigène qu’un anticorps de souris. C’est la «chimérisation» (B). On peut également greffer seulement les six boucles de l’anticorps murin à la place des boucles équivalents d’un anticorps humain. C’est l’ «humanisation».(C)

B – Chimérisation 
C – Humanisation
Une des fonctions biologiques des anticorps est de participer à l’élimination des antigènes étrangers (virus, bactéries, parasites) en se fixant à leur surface et en activant les mécanismes de défense de l’immunité adaptative (complément, cellules cytotoxiques). Les anticorps thérapeutiques injectés aux patients vont rediriger ces mécanismes vers les cellules cibles, tumorales en particulier. C’est ce qu’on appelle l’immunothérapie passive. On peut également se servir de ces anticorps comme vecteurs de composés toxiques : toxines, médicaments, atomes radioactifs. C’est l’immunociblage.
L’immunociblage d’atomes radioactifs a longtemps été envisagé pour le diagnostic en permettant de localiser les tumeurs par scintigraphie, mais aujourd’hui on préfère utiliser le 18F-fluoro désoxyglucose et la TEP. En revanche, des anticorps radiomarqués, avec de l’iode 131 ou de l’yttrium 90 sont déjà commercialisés pour traiter certains lymphomes par radioimmunopthérapie. Le cyclotron permet d’utiliser d’autres radioisotopes, comme le cuivre 67 ou le scandium 47, émetteurs de particules bêta moins qui ont des propriétés physiques intéressantes ou l’astate 211 qui est un émetteur de particules alpha, et d’étendre la radioimmunothérapie à d’autres cancers.
- Pour aller plus loin sur la radioimmunothérapie