De nombreux vecteurs de radioisotopes peuvent être utilisés pour l’imagerie et la thérapie de différentes pathologies (oncologie, cardiologie, neurologie). Pourtant un très petit nombre d’entre eux arrive au stade de l’utilisation clinique de routine. Le vecteur doit satisfaire à la fois à des conditions radiochimiques et biologiques (possibilité et facilité de radiomarquage sans altérer les propriétés biologiques du vecteur) mais aussi à des conditions cinétiques (distribution dans l’organisme), toxicologiques voire immunologiques (quand le vecteur est un anticorps).
Certains radioisotopes sont utilisés tels quels, comme :
- l’iode 131, sous forme d’iodure, pour la scintigraphie et la radiothérapie des cancers thyroïdiens
- le thallium 201 ou le rubidium 82 pour l’imagerie cardiaque
Dans le premier cas, les cellules thyroïdiennes fixent naturellement l’iodure. Dans le second, le thallium et le rubidium se comportent comme le potassium et permettent de visualiser les zones normalement irriguées du muscle cardiaque.
Dans la plupart des autres cas, il faut un vecteur pour guider le radioisotope vers les cellules ou les tissus à étudier. Le radioisotope est alors couplé de façon covalente à la molécule vectrice ou simplement complexé par l’intermédiaire d’une cage qui retient de façon très forte les métaux radioactifs. On appelle cette cage un «chélatant».
Petites molécules
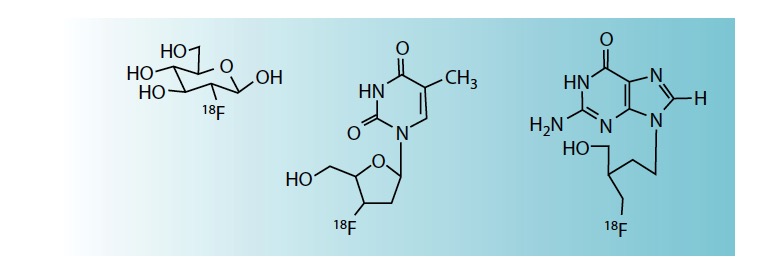
Les molécules vecteurs peuvent être de très petites molécules, comme par exemple le glucose, très utilisé sous forme de fluoro-désoxyglucose pour l’imagerie TEP des cancers. Les petites molécules peuvent cibler un transporteur, comme le transporteur GLUT-1 du glucose, qui les fait pénétrer dans la cellule où elles restent piégées car elles sont phosphorylées. C’est le cas du fluoro-désoxyglucose. C’est aussi le cas de la fluorothymidine, qui mime le nucléoside thymidine pour son transport et sa phosphorylation.
Pour ces molécules de très petit poids moléculaire, le couplage d’un groupement chimique encombrant comme un chélatant n’est pas envisageable car la capacité à passer par le transporteur ou à reconnaître un récepteur serait presque sûrement abolie. En revanche, on peut, par exemple, remplacer un carbone de la molécule par du carbone 11, émetteur bêta +. La molécule marquée est alors identique à la molécule native. Malheureusement la durée de vie du carbone 11, comme celle des isotopes émetteurs bêta + des autres composants majoritaires des cellules vivantes (azote, oxygène), est très courte (quelques minutes). Le fluor 18 est une alternative intéressante. Sa demi-vie est sensiblement plus longue (2 heures) et un atome de fluor peut souvent remplacer un groupement OH sans perte de fonction (fluoro-désoxyglucose).
Peptides
Les peptides sont aussi des vecteurs intéressants. On connaît de nombreux peptides capables de se fixer sur des récepteurs spécifiques qui sont beaucoup plus fortement exprimés par des cellules tumorales que sur les tissus sains. L’exemple le plus connu est la somatostatine qui possède des récepteurs exprimés par des cellules de l’estomac, de l’intestin et du pancréas. Un analogue plus stable et plus simple à synthétiser est utilisé, radiomarqué, pour détecter et détruire les cellules de tumeurs neuroendocrines gastro-entero-pancreatiques (les GEP NE).
Sous réserve de bien concevoir la molécule, le couplage de ces peptides à des chélatants pour un marquage avec des métaux radioactifs (indium 111 pour la scintigraphie, yttrium 90 ou lutétium 177 pour la thérapie) est possible. Il est même plus efficace qu’un marquage direct avec du carbone 11 ou avec un halogène (fluor 18, iode 123 ou 124) car ces peptides pénètrent dans les cellules après fixation sur leur récepteur. On dit qu’ils sont endocytés ou internalisés. Ils sont ensuite rapidement dégradés dans les lysosomes, par protéolyse, et les acides aminés sont recyclés hors des cellules cibles.
Les peptides ont tout de même quelques inconvénients : leur spécificité n’est pas absolue (présence de récepteurs sur des cellules normales), ils sont souvent vite dégradés dans la circulation et ils déposent une fraction importante de la radioactivité dans les reins qui est l’organe par lequel ils sont éliminés.
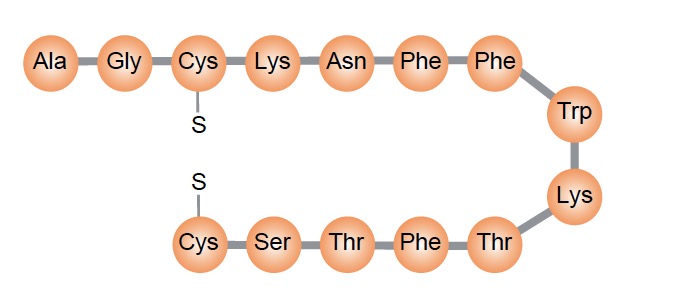
Des peptides dérivés de cette somatostatine sont utilisés pour traiter des tumeurs neuroendocrines et d’autres pathologies.
Anticorps
Les anticorps sont des vecteurs de choix. On sait en principe produire des anticorps contre toute sorte d’antigènes et on peut sélectionner des lignées de cellules immortelles sécrétant un anticorps unique. On peut alors obtenir des vecteurs très spécifiques d’antigènes exprimés quasi-exclusivement par des cellules tumorales. Ces anticorps sont des immunoglobulines, c’est-à-dire des protéines très stables (surtout les immunoglobulines G que l’on choisit le plus souvent) que l’on sait produire en très grandes quantités (kilogrammes) en culture cellulaire et modifier à l’envi. Ces anticorps servent à vectoriser toutes sortes de radioisotopes et principalement l’iode radioactif (iode 123 et iode 124 pour l’imagerie, iode 131 pour la thérapie) et des métaux comme l’yttrium 90. Il faut tout de même choisir des radioisotopes à durée de vie relativement longue car le temps de résidence de ces anticorps dans l’organisme et le temps nécessaire à leur fixation dans les tumeurs est assez long (plusieurs jours).
Les anticorps se prêtent à toutes sortes de modifications. On peut fabriquer des fragments pour accélérer leur distribution dans l’organisme ou créer des protéines hybrides pour développer des techniques de ciblage en plusieurs étapes. Les anticorps produits par des animaux (souris le plus souvent) et leurs dérivés peuvent induire des réponses du système immunitaire. On sait aujourd’hui par génie génétique les transformer en anticorps quasiment humains ou sélectionner directement des anticorps humains.

Vecteurs colloïdaux
Enfin, on peut utiliser des vecteurs colloïdaux renfermant des radioisotopes. Ces vecteurs colloïdaux peuvent être de simples émulsions d’huiles dans de l’eau, des liposomes (vésicules constituées d’une bicouche de phospholipides) ou des nanocapsules de compositions très diverses. Ces vecteurs colloïdaux sont aujourd’hui plutôt utilisés en administration locorégionale : le lipiodol, une émulsion huileuse marquée à l’iode 131 ou au rhénium 188, est injecté dans une artère hépatique irrigant les nodules de cancers hépatocellulaires. Les particules d’émulsion et la radioactivité qu’elles renferment restent alors piégées au niveau des tumeurs qu’elles irradient. Des recherches sont menées pour les utiliser aussi par injection.
